Traitements biologiques
Le traitement biologique (également appelé traitement par modificateurs de la réponse biologique ou immunothérapie) utilise le système immunitaire de l’organisme pour combattre le cancer ou pour réduire une partie des effets secondaires d’autres traitements anticancéreux. Il peut y parvenir en aidant à réparer les cellules saines endommagées par le cancer, ce qui permet à ces cellules saines de maîtriser le cancer, ou en interférant avec la croissance des cellules cancéreuses. Des termes tels qu’interférons, interleukines et facteur de nécrose tumorale se rapportent tous au traitement biologique et plusieurs types peuvent être utilisés seuls ou en combinaison avec une chimiothérapie ou une radiothérapie.
Les types de traitements biologiques comprennent :
- Traitement par anticorps monoclonal
- Radioimmunothérapie
- Interférons
- Vaccins (sous expérimentation clinique)
- Traitements par antiangiogénèse (sous expérimentation clinique)
- Thérapies géniques (sous expérimentation clinique).
Anticorps monoclonaux
Les anticorps monoclonaux sont de plus en plus disponibles et peuvent s’avérer efficaces dans le combat contre des types très particuliers de cancer. Un organisme sain produit normalement des anticorps pour lutter contre l’infection. La recherche médicale nous a permis de dupliquer maintenant ces anticorps en laboratoire. Toutefois, au lieu d’attaquer les microbes, ces anticorps monoclonaux peuvent être programmés pour attaquer les cellules lymphomateuses.
Le mot monoclonal vient des termes mono (signifiant un) et clonal (signifiant clone de). Ainsi, les anticorps monoclonaux désignent des anticorps qui sont tous des clones d’une seule cellule et ils sont tous identiques. Cette notion est importante, car lorsque l’organisme les envoie chasser les cellules cancéreuses, ils se comportent tous de façon identique.
Traitement par anticorps monoclonal
La mise au point d’anticorps monoclonaux constitue l’une des avancées les plus significatives du traitement du LNH. Les anticorps monoclonaux constituent un traitement plus spécifique que la chimiothérapie, ce qui signifie qu’ils sont dirigés vers une cible principalement située sur les cellules tumorales, contrairement aux cellules normales de l’organisme. Cette distinction en fait non seulement un traitement très efficace contre le cancer, mais elle réduit également fortement les effets secondaires, du fait que les cellules normales sont moins affectées. Un anticorps monoclonal peut être comparé à un missile guidé qui identifie une cible précise et qui la tue.
Les anticorps monoclonaux sont de différents types. Actuellement, au Canada, le rituximab (Rituxan®), l’ibritumomab tiuxetan (ZevalinMD) et le tositumomab (BexxarMD) sont des anticorps monoclonaux approuvés pour traiter le LNH. Les autres sont sous expérimentation.
Le rituximab, par exemple, est un anticorps chimérique, ce qui signifie qu’il est à moitié souris et à moitié humain. Les anticorps monoclonaux murins sont entièrement issus de souris. Les anticorps humanisés sont des anticorps qui étaient partiellement murins au début, puis qui ont été entièrement convertis en anticorps humains. Enfin, les anticorps entièrement humains sont entièrement humains dès le début. Des recherches sont également en cours sur les anticorps primatisés (singes).
Comment fonctionnent les anticorps monoclonaux?
Toutes les cellules comportent certains marqueurs protéiques sur leur surface, appelés antigènes. Les anticorps monoclonaux sont spécifiquement fabriqués en laboratoire pour reconnaître un type d’antigène. Pour le LNH, les anticorps monoclonaux sont spécifiquement ciblés sur les antigènes que l’on trouve sur les lymphocytes, les cellules normales de l’organisme desquels dérivent les lymphomes. La fixation de l’anticorps monoclonal sur son antigène cible déclenche l’auto-destruction de la cellule et indique au système immunitaire de l’organisme d’attaquer et de tuer la cellule cancéreuse.
L’antigène le plus couramment recherché s’appelle CD20. CD20 se trouve sur la plupart des lymphocytes B du lymphome et sur de nombreux lymphocytes B normaux également. Il s’agit donc d’une cible idéale pour un traitement à base d’anticorps. Cependant, des recherches ont également cours sur des anticorps monoclonaux ciblant les antigènes CD22, CD30, CD40, CD52 et CD80.
Le rituximab est un traitement couramment utilisé pour les patients souffrant d’un lymphome non hodgkinien (LNH) indolent ou agressif. Il est utilisé seul ou combiné à la chimiothérapie et présente un potentiel avéré d’augmentation de la durée de rémission du LNH indolent (à croissance lente). Il peut également augmenter chez le patient la possibilité de guérir d’un LNH agressif (à croissance rapide).
L’alemtuzumab (CampathMD) cible CD52, une protéine se trouvant à la surface des lymphocytes matures, mais pas sur les cellules souches à partir desquelles ces lymphocytes sont dérivés. On l’utilise chez les patients atteints de LLC.
Les anticorps monoclonaux peuvent également être combinés à la radiothérapie, qui dirige une dose de rayons directement dans la cellule lymphomateuse. Ces traitements sont appelés radioimmunothérapies et sont présentés dans la section intitulée Radioimmunothérapie.
Rituximab (Rituxan®)
Le rituximab est un anticorps monoclonal qui se fixe solidement à l’antigène CD20, à la surface des lymphocytes B, la cellule cancéreuse de nombreux types de LNH. L’antigène CD20 est également présent à la surface de lymphocytes B non cancéreux sains, ce qui signifie que le rituximab se fixe également sur ces cellules et en facilite la destruction. Cependant, les lymphocytes B normaux, comme toutes les cellules sanguines, sont produits dans la moelle osseuse à partir de cellules souches, et ces dernières ne possèdent pas l’antigène CD20, ce qui signifie qu’elles ne sont pas concernées par les anticorps monoclonaux et ne sont pas détruites. Les cellules souches peuvent reconstituer le stock de lymphocytes B sains dans l’organisme. Ainsi, bien que pendant le traitement au moyen du rituximab le nombre de lymphocytes B normaux matures soit temporairement réduit, leur taux revient à la normale dès la fin du traitement. Le rituximab est un traitement couramment utilisé pour les patients souffrant d’un lymphome non hodgkinien (LNH) indolent ou agressif. Il est utilisé seul ou combiné à la chimiothérapie et présente un potentiel avéré d’augmentation de la durée de rémission du LNH indolent (à croissance lente). Il peut également augmenter chez le patient la possibilité de guérir d’un LNH agressif (à croissance rapide).
Les anticorps monoclonaux peuvent également être combinés à la radiothérapie, qui dirige une dose de rayons directement dans la cellule lymphomateuse. Ces traitements sont appelés radioimmunothérapies et sont présentés dans la section intitulée Radioimmunothérapie.
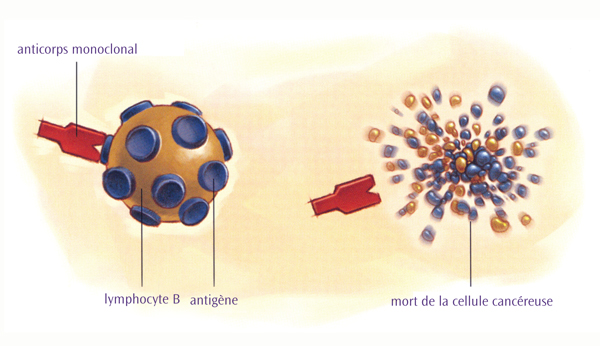
Traitement par anticorps monoclonal
Comment sont administrés les anticorps monoclonaux?
Le rituximab est administré par intraveineuse, seul ou en combinaison avec une chimiothérapie, ce qui augmente souvent l’efficacité de cette dernière, tandis que l’alemtuzumab (CampathMD) est administré seul (monothérapie). Des médicaments visant à prévenir les effets indésirables sont donnés avant le traitement par anticorps monoclonal. Si des effets indésirables surviennent, le traitement peut être donné à une vitesse de perfusion inférieure, ou interrompu jusqu’à ce que les effets secondaires se dissipent.
Seul, le rituximab est généralement donné sous forme de quatre traitements hebdomadaires sur une période de 22 jours. En combinaison avec une chimiothérapie, une dose de rituximab est administrée avec chaque cycle de traitement (généralement huit cycles).
Les perfusions d’alemtuzumab prennent généralement deux heures. Les quelques premières doses sont généralement données progressivement, jusqu’à ce que la dose recommandée soit atteinte. Par exemple, vous recevez une très faible dose le premier jour du traitement. Si aucun effet secondaire sérieux n’apparaît, vous recevez le lendemain une dose légèrement supérieure à celle reçue la veille. Presque tous les patients parviennent à atteindre la dose recommandée en trois à sept jours. Dès que vous avez atteint la dose recommandée, le calendrier de traitement est tous les deux jours, trois jours par semaine. Vous pouvez recevoir ce traitement jusqu’à 12 semaines, tant que les cellules cancéreuses continuent à répondre à ce traitement et que vous tolérez les effets secondaires.
Thérapie d’entretien au rituximab
Un traitement prolongé au rituximab, appelé traitement d’entretien au rituximab, est utilisé pour traiter les patients atteints de LNH folliculaire qui ont bien répondu à leur traitement initial. Cela signifie que les patients qui ont reçu un traitement pour un lymphome folliculaire et qui ont atteint la rémission (complète ou partielle) peuvent bénéficier d’une administration prolongée de rituximab (généralement tous les trois mois pendant une période de deux ans). Le traitement d’entretien au rituximab a montré qu’il maintenait la réponse obtenue par le traitement initial et qu’il pouvait améliorer la survie des patients atteints d’un lymphome folliculaire. Adressez-vous à votre médecin pour obtenir plus de renseignements sur le traitement d’entretien au rituximab.
Des effets secondaires sont-ils associés à un traitement par anticorps monoclonal?
Contrairement aux effets secondaires d’une chimiothérapie et d’une radiothérapie, presque tous les effets secondaires d’un traitement par anticorps monoclonal sont mineurs et de courte durée (ne se poursuivant que pendant l’administration du traitement et quelques heures après). Les risques de connaître des effets secondaires diminuent également à chaque traitement reçu, car le patient s’ajuste au traitement et, au fur et à mesure du traitement, les cellules lymphomateuses à tuer sont moins nombreuses. Les effets secondaires les plus courants sont des symptômes tels que ceux de la grippe, comme la fièvre, des frissons et la transpiration. Les effets secondaires moins courants comprennent des nausées, des vomissements, des rougeurs, la fatigue, des maux de tête, une respiration sifflante, une infection et une sensation de langue ou de gorge tuméfiée. On surveille les patients tout au long de la session de traitement pour déceler les signes éventuels de réactions allergiques comme des démangeaisons, des rougeurs, une respiration sifflante et une tuméfaction. Si ces symptômes surviennent, le traitement est ralenti ou interrompu un court moment jusqu’à leur disparition. Des antihistaminiques (p. ex., BénadrylMD) et de l’acétaminophène sont couramment donnés avant le traitement, pour éviter les réactions allergiques.
Radioimmunothérapie
La radioimmunothérapie utilise à la fois la radiothérapie et la thérapie par anticorps monoclonal pour lutter contre le lymphome. Une molécule radioactive (molécule qui émet un rayonnement et qui est capable de tuer des cellules cancéreuses) est fixée à un anticorps monoclonal, de sorte que le rayonnement cible précisément les cellules du lymphome. Elle utilise le mécanisme de ciblage efficace de l’anticorps monoclonal et l’effet d’élimination du cancer par le rayonnement. Cela a pour avantage de produire le rayonnement mortel sur les cellules à proximité de l’anticorps, même si aucun anticorps n’y est fixé.
Deux agents de radioimmunothérapie sont actuellement disponibles au Canada pour le traitement du LNH. Ces agents, appelés ibritumomab tiuxetan (ZevalinMD) et tositumomab (BexxarMD), ciblent l’antigène CD20 sur les cellules B. Ils sont couramment donnés aux patients souffrant de LNH indolent, qui ne répondent plus à la chimiothérapie classique ni au traitement par anticorps monoclonal au moyen du rituximab.
Comment fonctionne la radioimmunothérapie?
La radioimmunothérapie utilise des anticorps monoclonaux auxquels sont fixées des substances radioactives. Ces anticorps monoclonaux radioactifs circulent dans l’organisme jusqu’à ce qu’ils trouvent leur cible, l’antigène CD20 du lymphocyte B (une protéine que l’on trouve spécifiquement sur les lymphocytes B), et se fixent à lui. Une fois qu’ils sont fixés, le rayonnement tue la cellule B cancéreuse ainsi que toutes les autres cellules lymphomateuses qui sont à proximité.
Comment sont administrées les radioimmunothérapies?
Les radioimmunothérapies sont administrées par intraveineuse au département de médecine nucléaire de l’hôpital, sous la surveillance d’un médecin qui est spécialement formé et expérimenté dans l’utilisation et la manipulation sans risque des radioisotopes. Une infirmière ou un technicien assistera le médecin et restera à vos côtés pendant le traitement.
D’autres membres de l’équipe de traitement peuvent comprendre :
- Un hématologue de l’équipe de traitement : médecin spécialisé dans les maladies du sang, telles que le LNH.
- Oncologue : médecin spécialisé dans le traitement du cancer.
- Infirmière oncologue : spécialiste qui vous informe sur votre traitement et vous aide pour vos soins.
- Spécialiste en médecine nucléaire : médecin formé en radiothérapie, qui décide de votre dose individuelle de la partie radioactive du traitement. Le spécialiste en médecine nucléaire peut également intervenir en tant qu’agent de sécurité en radiation dans un centre de traitement.
- Technologue en médecine nucléaire : spécialiste qui assiste le médecin spécialiste en médecine nucléaire. Il est habilité à administrer la partie radioactive du traitement et à réaliser les procédures d’imagerie.
- Radio-oncologue : médecin utilisant le rayonnement pour traiter le cancer.
- Pharmacien hospitalier : spécialiste de la pharmacie pouvant préparer la partie non radioactive du traitement.
- Radiopharmacien : spécialiste préparant l’anticorps radioactif.
- Un agent de sécurité en radiation : employé de l’hôpital ou du centre de traitement qui connaît les règles d’utilisation des substances radioactives. Cette personne décide également si vous pourrez rentrer chez vous après le traitement.
Quels sont les avantages de la radioimmunothérapie dans le traitement du LNH?
Les avantages possibles de la radioimmunothérapie pour le LNH comprennent :
- Une activité antitumorale améliorée pouvant être due à la distribution ciblée de particules radioactives à la surface de cellules cancéreuses. Cette activité s’ajoute à d’autres mécanismes d’action que peut posséder l’anticorps monoclonal, notamment des interactions avec le système immunitaire et l’induction de l’apoptose.
- Les anticorps monoclonaux radiomarqués peuvent émettre un rayonnement sur les cellules environnantes dans une tumeur par un effet de feu croisé. Ce phénomène peut tuer les cellules tumorales adjacentes qui sont négatives à l’égard de l’antigène (c.-à-d. les cellules auxquelles les anticorps monoclonaux ne peuvent pas se lier) ou dans lesquelles les anticorps monoclonaux n’ont pas pénétré.
Quels sont les effets secondaires associés à la radioimmunothérapie?
Certains effets secondaires dus à la radioimmunothérapie peuvent faire l’objet d’une discussion avec votre médecin. Ils comprennent l’anémie (faible nombre de globules rouges), la thrombocytopénie (faible nombre de plaquettes) et l’immunosuppression (baisse d’une fonction immune, un état qui peut entraîner un plus grand risque que vous contractiez une infection). D’autres effets secondaires courants comprennent des frissons, de la fièvre, des nausées et une irritation de la gorge. Tout comme pour n’importe quelle radiothérapie, il existe des risques accrus à long terme de certains cancers.
Il peut être nécessaire de parler avec un médecin des mesures de sécurité à prendre après une radioimmunothérapie, car une faible quantité de rayonnement peut persister dans l’organisme, à savoir dans le sang et l’urine, pendant une courte période après le traitement. Ces mesures peuvent consister à se laver soigneusement les mains après la miction et à utiliser un préservatif pendant les relations sexuelles. Tirer deux fois la chasse d’eau après être allé aux toilettes est également une bonne idée.
Votre équipe de soins peut déterminer si la radioimmunothérapie est le traitement qui vous convient.
Qui est un candidat à la radioimmunothérapie?
Votre médecin tiendra compte de nombreux facteurs pour déterminer si vous êtes un bon candidat à ce traitement. Ces facteurs comprennent le type spécifique de lymphome que vous avez ainsi que plusieurs considérations importantes pour réduire les risques potentiels du traitement. Des facteurs tels que le type de traitement contre le lymphome que vous avez reçu précédemment, le pourcentage de cellules lymphomateuses dans votre moelle osseuse, votre numération globulaire et les éventuelles allergies ou réactions que vous pouvez avoir vis-à-vis d’un quelconque composant du régime sont tous importants dans le processus de décision.
Ibritumomab tiuxetan (ZevalinMD)
Comment est administré l’ibritumomab tiuxetan?
Le schéma thérapeutique de l’ibritumomab tiuxetan, consistant en deux doses préalables de rituximab suivies par une dose d’ibritumomab tiuxetan, s’étend sur un cycle de huit jours. Du fait que des scans d’imagerie ne sont pas nécessaires pour déterminer la dose qui vous convient, le traitement à l’ibritumomab tiuxetan est terminé après deux visites à l’hôpital seulement, en consultation externe.
Le premier jour, vous recevrez d’abord une perfusion par intraveineuse de rituximab, ce qui prend quelques heures. Le rituximab permet à l’ibritumomab tiuxetan d’améliorer le ciblage des cellules cancéreuses.
Huit jours après la visite initiale, vous retournerez recevoir une seconde perfusion de rituximab, suivie par une dose d’ibritumomab tiuxetan, qui est administré par perfusion intraveineuse et qui dure une dizaine de minutes. Une infirmière ou un technicien restera avec vous au cours du traitement.
Quelles précautions faut-il prendre après avoir reçu l’ibritumomab tiuxetan?
Vous devez discuter avec votre médecin des mesures de sécurité à prendre et de toute question ou tout problème que vous pouvez avoir. L’ibritumomab tiuxetan émet un rayonnement bêta pur, qui ne pénètre pas en dehors de l’organisme. En outre, après le traitement, vous devrez suivre des mesures de sécurité minimales contre le rayonnement. Une faible quantité de rayonnement peut perdurer dans le sang et l’urine jusqu’à une semaine après le traitement. Il est donc recommandé de respecter quelques mesures de sécurité jusqu’à une semaine après le traitement.
Généralement, l’isolement n’est pas nécessaire, et il est inutile d’éviter de rencontrer sa famille, ses amis ou
ses collègues. Aucune protection particulière contre le rayonnement n’est nécessaire chez vous ni dans votre lieu de travail. Vous pouvez normalement retourner au travail et reprendre une activité normale après le traitement, et il ne vous est pas interdit de voyager. Votre médecin vous fournira des instructions et des recommandations supplémentaires.
Certaines mesures de sécurité doivent être prises pendant sept jours :
- Lavez-vous soigneusement les mains après être allé aux toilettes.
- Utilisez un préservatif pendant un rapport sexuel pour éviter le transfert de fluides corporels. Les hommes qui ont reçu de l’ibritumomab tiuxetan et qui sont en âge de procréer doivent utiliser une contraception fiable pendant le traitement et un an après la fin de ce dernier.
- Précautions concernant la grossesse : les femmes doivent utiliser une contraception fiable. Toute grossesse doit être évitée avant le début du traitement, ainsi que pendant le traitement et un an après la fin de ce dernier.
- Femmes allaitantes : parlez à votre médecin avant de commencer à allaiter et à la fin du traitement, car les anticorps sont excrétés dans le lait maternel.
Quels sont les effets secondaires associés à l’ibritumomab tiuxetan?
Du fait que le schéma de traitement au ibritumomab tiuxetan comprend l’administration de rituximab, les effets secondaires de ces deux produits doivent être abordés. Les effets secondaires les plus courants signalés par les patients en ce qui concerne le traitement à l’ibritumomab tiuxetan sont des symptômes ressemblant à ceux d’une légère grippe, semblables à ceux rapportés avec le rituximab. Ces effets secondaires temporaires comprennent une faiblesse, des douleurs abdominales et dorsales, des essoufflements, des frissons, une fièvre, une irritation de la gorge, une toux importante, des maux de tête, des nausées, des vomissements, des étourdissements et une éruption.
Il est important que vous rapportiez immédiatement à votre médecin tous les symptômes ressentis au cours de la prise du rituximab ou de l’ibritumomab tiuxetan, car il est possible qu’il y ait des indications d’effets secondaires potentiellement plus graves. Dans de rares cas, de graves réactions allergiques au rituximab sont survenues.
Tositumomab (BexxarMD)
Comment fonctionne le tositumomab?
Le tositumomab est un traitement à double action contre le LNH, car il attaque les cellules cancéreuses de deux façons, en utilisant la radiothérapie et la thérapie biologique en un seul traitement. L’action de la thérapie biologique est apportée par l’anticorps monoclonal appelé tositumomab. Le tositumomab recherche l’antigène CD20 à la surface des cellules du LNH et s’y fixe. L’action de la radiothérapie du tositumomab provient d’une substance radioactive, appelée un isotope, qui est fixée à l’anticorps monoclonal. L’isotope est l’iode 131.
Tout d’abord, le tositumomab auquel est fixé l’iode 131 trouve les cellules lymphomateuses et s’y fixe L’anticorps monoclonal sollicite les défenses naturelles de votre organisme pour qu’elles attaquent les cellules cancéreuses. Lorsque le tositumomab se lie aux cellules cancéreuses, l’iode 131 libère un rayonnement qui tue les cellules fixées ainsi que les cellules environnantes.
L’anticorps monoclonal tositumomab se fixe lui-même à l’antigène CD20. Le tositumomab est conçu pour s’ajuster à l’antigène CD20, comme une clé dans une serrure. Ce type de traitement ciblé utilise le pouvoir d’élimination des cellules propre au rayonnement, c’est-à-dire l’iode 131, et l’applique à la tumeur du LNH. Du fait que l’isotope est fixé au tositumomab, il émet un rayonnement directement vers les cellules cancéreuses.
Que se passe-t-il pendant le traitement?
Le tositumomab est administré dans un hôpital ou un centre de traitement pendant quatre visites réparties sur une à deux semaines. Il est généralement donné en consultation externe. Toutefois, selon la quantité totale de rayonnement émis, les réglementations en matière de sécurité radiologique de votre province/hôpital, et votre propre situation à domicile, il peut être nécessaire de vous admettre à l’hôpital pendant deux ou trois jours.
Le tositumomab est donné en deux étapes. La première étape est l’étape dosimétrique, et la seconde, l’étape thérapeutique. Dans l’étape dosimétrique, votre spécialiste en médecine nucléaire ou votre oncologue spécialiste du rayonnement détermine la quantité de rayonnement qui vous convient. Trois visites à l’hôpital ou au centre de traitement sont requises.
Comment est administré le tositumomab?
Avant de commencer votre thérapie au tositumomab, votre équipe soignante vous donnera un médicament pour essayer de réduire certains de ses effets secondaires pouvant survenir avec les perfusions. Ces médicaments s’appellent des prémédications et comprennent :
- l’acétaminophène (p. ex., TylénolMD) pour faire baisser la fièvre;
- la diphénhydramine (p. ex., BénadrylMD) pour atténuer les réactions allergiques ou les symptômes ressemblant à ceux de la grippe.
Ensuite, vous recevrez une dose de tositumomab sans aucun rayonnement. Il s’agit d’une perfusion intraveineuse qui durera environ une heure. Vous recevrez ensuite la dose dosimétrique, qui consiste en le tositumomab plus une faible quantité d’iode 131. Cette perfusion durera environ 20 minutes. Après avoir reçu la dose dosimétrique, l’équipe de médecine nucléaire effectuera un scan avec une caméra gamma. Le scan doit être terminé avant que vous uriniez, veillez donc à uriner avant le début de la première perfusion. Le scan dure généralement moins de 10 minutes.
Votre équipe de médecine nucléaire utilisera ces renseignements pour déterminer à quelle vitesse la substance radioactive quitte votre organisme (la vitesse est différente pour chaque personne). Au même moment, le spécialiste en médecine nucléaire ou l’oncologue spécialiste du rayonnement prendra une photographie pour observer où se dirige la radioactivité dans votre organisme.
Pendant les perfusions, l’équipe de traitement prendra votre pression sanguine, votre fréquence cardiaque, votre respiration et votre température. En cas de changement, l’équipe peut décider de ralentir ou d’interrompre la perfusion. Le tositumomab peut provoquer des réactions, car il contient des protéines que l’on ne trouve généralement pas dans l’organisme. À la fin du traitement, une fois de retour chez vous, veillez à appeler votre oncologue ou hématologue si des effets secondaires empirent, ou si de nouveaux apparaissent à cause du traitement au tositumomab.
Protection de votre thyroïde
Votre thyroïde produit des substances chimiques dont votre organisme a besoin pour fonctionner correctement. À cette fin, elle absorbe l’iode provenant de votre circulation sanguine. Du fait que l’isotope dans le tositumomab est une forme radioactive de l’iode, il est important d’empêcher que votre thyroïde l’absorbe. Votre médecin vous donnera un médicament de protection de la thyroïde sous forme de comprimé ou de liquide. Vous devez prendre la première dose 24 heures avant votre première visite. Vous ne pourrez pas être traité au tositumomab si vous ne prenez pas votre médicament de protection de la thyroïde 24 heures avant le moment prévu du traitement. Vous devez également continuer à prendre ce médicament tous les jours pendant le traitement, et deux semaines après le dernier jour du traitement. Après un traitement au tositumomab, vous devez faire vérifier votre fonction thyroïdienne chaque année par votre médecin. Il suffit d’un simple test sanguin.
Quels sont les effets secondaires associés au tositumomab?
- Les femmes enceintes ne doivent pas prendre de tositumomab. Les mères allaitantes recevant du tositumomab doivent arrêter d’allaiter.
- Utilisez des méthodes efficaces de contraception pendant le traitement et 12 mois après.
Sécurité radiologique
Tant que l’iode 131 du tositumomab se trouvera dans votre organisme, vous émettrez un rayonnement. L’iode est éliminé de votre organisme par les reins, la majeure partie de la radioactivité le quitte donc par l’urine pendant environ une semaine. Les professionnels de santé du service de médecine nucléaire de l’hôpital ou du centre de traitement où vous recevrez le traitement au tositumomab connaissent bien l’iode 131 et ont été formés en matière de procédures de sécurité radiologique. Ils vous expliqueront les instructions simples que vous devrez respecter après votre traitement au tositumomab afin de réduire le risque d’exposition des autres personnes au rayonnement.
Il y a trois éléments dont il faut se souvenir pour limiter la quantité de rayonnement que les autres peuvent recevoir de vous après votre traitement au tositumomab :
1. Distance : plus vous êtes loin des autres personnes, moins elles reçoivent de rayonnement de votre part.
2 Temps : la quantité de rayonnement à laquelle sont exposées les personnes autour de vous dépend de la durée pendant laquelle elles sont près de vous.
3. Hygiène : quelques mesures d’hygiène (soins personnels) garantiront que les personnes autour de vous sont exposées le moins possible au rayonnement.
Interférons
L’interféron est une molécule protéique qui est naturellement produite par le système immunitaire de l’organisme pour aider à lutter contre l’infection et tuer les cellules cancéreuses de l’organisme. Une forme synthétique d’interféron a été produite et est utilisée pour traiter certains types de LNH. On pense que l’interféron tue directement les cellules tumorales et indique au reste du système immunitaire de faire la même chose. L’interféron peut être donné en tant que thérapie d’entretien pour prolonger la rémission de patients précédemment traités par chimiothérapie.
Des symptômes ressemblant à ceux de la grippe constituent les effets secondaires les plus courants dus au traitement par interféron. Ces symptômes peuvent consister en une légère fièvre, de la fatigue, une sensation de faiblesse et des douleurs musculaires et articulaires. Une bonne hydratation aide souvent à diminuer ces effets secondaires, de même que des analgésiques vendus sans ordonnance, si votre médecin vous le recommande. La thérapie par interféron peut parfois provoquer une dépression grave. Informez votre médecin si vous vous sentez déprimé. Les effets secondaires moins courants de la thérapie par interféron comprennent la perte d’appétit, l’aversion pour la nourriture et une baisse de la fonction thyroïdienne. En raison du grand nombre d’effets secondaires associés et de la multitude de nouvelles options de traitement, l’interféron est rarement utilisé contre le LNH. Ce traitement est toutefois utilisé pour traiter les lymphomes à cellules T.
Vaccins
Nous connaissons tous les vaccins standards contre des maladies telles que la polio ou le tétanos. Les vaccins fonctionnent par injection d’une partie inactive d’une molécule d’une maladie, trop faible pour provoquer la maladie, mais suffisamment puissante pour stimuler la production d’anticorps. Lors d’une nouvelle exposition à cette même maladie, l’organisme est prêt à se défendre contre elle.
Les vaccins sont actuellement étudiés en tant que traitement potentiel contre le lymphome, mais leur utilisation n’est pas encore approuvée. Ces vaccins sont personnalisés selon la tumeur unique à chaque personne. Une petite quantité de la tumeur d’un patient est prélevée sur un ganglion lymphatique, modifiée pour la faire ressembler à un envahisseur étranger (pour que le système immunitaire du patient l’attaque), et réinjectée dans le patient pour stimuler la production d’anticorps et une réponse immunitaire. L’idée est que le système immunitaire attaque alors la tumeur et la détruise.
On ne sait pas dans quelle mesure ces vaccins seront efficaces, mais ils semblent prometteurs. Un des objectifs principaux du traitement anticancéreux est la mise au point de thérapies moins toxiques que la chimiothérapie.
Traitement par antiangiogénèse
L’angiogénèse est le développement de nouveaux vaisseaux sanguins. De nombreux cancers sont capables de stimuler une angiogénèse, c’est-à-dire la formation de nouveaux vaisseaux sanguins, dans le but de fournir de l’énergie à la tumeur croissante et de l’alimenter. Les traitements par antiangiogénèse arrêtent le développement de nouveaux vaisseaux sanguins et détruisent les vaisseaux anormaux existants entourant les tumeurs. Le but est de couper l’alimentation en carburant des tumeurs croissantes et de faciliter la mort des cellules tumorales. Les traitements par antiangiogénèse sont actuellement sous expérimentation dans la thérapie du lymphome.
Thérapie génique
Le but principal de la thérapie génique consiste à modifier la structure génétique des cellules cancéreuses de sorte qu’elles ne puissent plus croître, ou qu’elles puissent être reconnues par le système immunitaire de l’organisme et qu’il les détruise. D’autres types de thérapies géniques peuvent rendre les cellules cancéreuses plus vulnérables à la chimiothérapie, et les cellules normales moins vulnérables. Cette possibilité peut augmenter l’efficacité de la chimiothérapie et réduire les effets secondaires toxiques. Les thérapies géniques sont encore sous expérimentation, mais sont porteuses de promesses pour les futurs traitements anticancéreux.





